SARS-CoV-2高关注变异株之间的环境稳定性差异:Omicron变异株具有更高稳定性
2022-02-16
博客
关键词
SARS-CoV-2;高关注变异株;稳定性;消毒效果;人体皮肤;存活时间;感染控制;接触传播
摘要
我们分析了SARS-CoV-2武汉株系和所有高关注变异株(VOCs)之间的病毒环境稳定性差异。在塑料和皮肤表面,Alpha、Beta、Delta和Omicron变异株的存活时间比武汉株系长两倍以上,且在皮肤表面的传染性持续超过16小时。这些高关注变异株的高环境稳定性可能会增加接触传播的风险,导致进一步病毒扩散。
引言
2020年至2021年以来,各种SARS-CoV-2变异株相继出现。特别是归类为“高关注变异株”的SARS-eoV-2变异株,会造成重大人员、经济损失。因此,了解各变异株的特点对感染控制至关重要。据报道,高关注变异株具有较高的传染性和传播性(1)。特别是Omicron(Pango谱系:B.1.1.529)变异株的快速传播,截至2022年已成为全球关注的严重问题(2,3)。传染性/传播性增加可归因于多种因素,如感染者散播病毒载量增加、病毒散播期延长、造成感染所需的最低病毒载量降低、感染靶部位改变、环境稳定性增加等(4,5)。
有研究者比较了SARS-CoV-2与SARS-CoV-1、流感病毒等其他病毒的环境稳定性(6,7)。此外,之前的研究还表明,Alpha(Pango谱系:B.1.1.7)和Beta(Pango谱系:B.1.351)变异株具有同等程度的环境稳定性(8,9)。然而,对于包括Omicron和Delta(Pango谱系:B.1.617.2)在内的所有高关注变异株之间的病毒稳定性差异,目前尚未有研究进行详细评价和比较。本研究改进了之前开发的评价模型,精确分析了武汉株系(Pango谱系:A)与所有高关注变异株在病毒稳定性和消毒效果方面的差异。
材料与方法 病毒和细胞
本研究中分析的SARS-CoV-2变异株包括武汉株系(Pango谱系:A,hCoV-19/Japan/TY/WK-521/2019)、Alpha变异株(Pango谱系:B.l.1.7,hCoV-19/Japan/QK002/2020)、Beta变异株(Pango谱系:B.1.351,hCoV-19/Japan/TY8-612/2021)、Gamma变异株(Pango谱系:P.l,hCoV-19/Japan/TY7-501/2021)、Delta变异株(Pango谱系:B.l.617.2,hCoV-19/Japan/TYll-927/2021)和Omicron变异株(Pango谱系:B.l.1.529, hCoV-19/Japan/TY38-873/2021)。所有病毒均由日本国立传染病研究所(National Institute of Infectious Diseases,日本东京)慷慨提供。自日本JCRB细胞保藏中心(Japanese Collection of Research Bioresources Cell Bank,日本大阪)购入表达跨膜丝氨酸蛋白酶TMPRSS2的VeroE6/TMPRSS2细胞,并将其在添加了5%胎牛血清和G418(Nacalai Tesque,日本京都)的Dulbecco改良Eagle培养基(DMEM;Sigma Aldrich)中培养,进行病毒培养与定量(10,11)。按如下步骤进行病毒浓缩和纯化:感染后96小时,收获培养基,并在4℃、2500×g条件下离心10分钟,消除细胞碎片。使用Beckman SW28转子,在4℃、27000 rpm条件下,磷酸盐缓冲盐水(PBS)、20%(w/w)蔗糖垫超速离心2.5小时,沉淀上清液中的病毒粒子(12,13)。在VeroE6/TMPRSS2细胞中以半数组织培养感染剂量(TCID50)测定病毒滴度。接种三天后,在显微镜下对各孔细胞病变效应进行评分,并计算TCID50。
评价病毒稳定性和消毒效果所用皮肤模型的构建
从京都府立医科大学法医学系获取的法医尸检标本中采集人体皮肤。将死亡后约1天获取的20-70岁受试者的腹部皮肤尸检标本切成尺寸约为4 cm×8 cm的方块。如受试者皮肤因灼烧或溺水严重受损,则不予采集。采用皮肤尸检标本开发离体模型,用以评价不同病毒在人体皮肤表面的稳定性以及不同消毒剂对人体皮肤表面病毒的消毒效果(6,14)。用PBS清洗去除脂膜的皮肤,将其置于培养池(Corning,美国纽约)中,并放置在孔径为8.0 µm的膜上。将培养池置于含1.0 mL DMEM(Sigma-Aldrich)的六孔板中。
塑料表面和人体皮肤表面病毒稳定性评价
对塑料(聚苯乙烯板)表面和人体皮肤(构建的皮肤模型)表面的病毒存活情况进行评价。将病毒溶液(5.0×104 TCID50/2 µL PBS)涂于塑料或人体皮肤表面。每份样本在受控条件下(25℃,45-55% RH)孵育0-120小时,而后收集表面残留的病毒于1.0 mL DMEM培养基中并滴定(6)。表面残留病毒滴度的检测限为100.5TCID50。病毒存活时间定义为表面无法检测出病毒的时间。每种条件进行三次独立实验。表面残留病毒滴度结果以平均值±均值标准误表示。
醇基消毒剂消毒效果评价
对不同浓度的醇基消毒剂进行消毒效果评价。对浓度分别为80%、60%、50%、40%、35%、32.5%、30%、27.5%、25%、22.5%和20%(w/w)的乙醇产品(EA,Nacalai Tesque)进行消毒效果检测。对浓度为70%(w/w)的异丙醇(IPA,Nacalai Tesque)进行检测。
首先,对消毒剂的消毒效果进行体外评价。将5 µL含病毒的PBS(5.0×104 TCID50/5 µL PBS)在1500 µL的试管中与45 µL各种消毒剂混合15秒。随后,用450 µL DMEM培养基中和所得溶液,并测定残留病毒滴度(14)。病毒滴度的检测限为100.2TCID50。
而后,用已构建的模型评价消毒剂对人体皮肤表面病毒的消毒效果(离体评价)。将每种病毒溶液(1.0×105 TCID50/2 uL PBS)涂于人体皮肤表面。然后将每份皮肤样本在25℃、45%-55%RH条件下孵育15分钟,使皮肤表面的病毒混合物完全干燥。随后,将18 µL消毒剂涂于每份皮肤样本表面15秒,然后风干5分钟。干燥后,用1000 µL DMEM回收皮肤表面的残留病毒,并测定残留病毒载量(14)。病毒滴度的检测限为100.5TCID50。为测定每种条件下消毒剂的消毒效果,计算病毒滴度的对数减少值,归一化为PBS对照滴度。每种条件进行三次独立实验,实验结果以平均值±均值标准误表示。
伦理考量
本研究方案,包括样本采集程序,已获得京都府立医科大学伦理委员会审核批准(ERB-C-1593),且已获得所有研究参与者书面知情同意。
统计分析
使用GraphPad Prism 7(GraphPad,Inc.,La Jolla,CA,USA)进行数据分析。经过的时间定义为解释变量(X轴),对数病毒滴度定义为被解释变量(Y轴)。使用对数连结函数进行线性回归分析,创建回归曲线。SARS-CoV-2滴度的测定限为100.5 TCID50;因此,病毒的存活时间定义为回归曲线Y值为0.5时的X值。当表面残留病毒滴度为2.0和3.0 log10TCID50时,根据每条回归曲线的斜率计算半衰期(6,12)。
结果
测量塑料表面或人体皮肤表面残留病毒滴度随时间的变化情况(如补充图Sl),并通过回归分析根据这些滴度值计算存活时间和半衰期(如补充图S2)。在塑料表面分析中,武汉株系、Alpha、Beta、Gamma、Delta和Omicron变异株的存活时间分别为56.0小时(95%置信区间[Cl],39.0-76.7小时)、191.3小时(95%CI,152.5-232.1小时)、156.6 小时(95%CI,122.7-192.9小时)、59.3小时(95%CI,43.9-77.7小时)、114.0小时(95%CI,91.3-139.1小时)和193.5小时(95%CI,153.1-236.2小时)(如图lA和补充表S1所示)。在人体皮肤表面分析中,武汉株系、Alpha、Beta、Gamma、Delta和Omicron变异株的存活时间分别为8.6小时(95%Cl,6.5-10.9小时)、19.6小时(95%CI,14.8-25.3小时)、19.1小时(95%CI,13.9-25.3小时)、11.0小时(95%CI,8.1-14.7小时)、16.8小时(95%CI,13.1-21.1小时)和21.1小时(95%CI,15.8-27.6小时)(如图lB和补充表S1所示)。Alpha、Beta、Delta和Omicron变异株的存活时间显著长于武汉株系;Omicron变异株的存活时间最长。此外,半衰期显示出与存活时间相同的趋势(如图1C、1D和补充表S2所示)。
体外消毒效果评价显示,武汉株系和Gamma变异株在32.5%EA作用下15秒内完全灭活(对数减少值>4),Alpha、Beta和Delta变异株在35%EA作用下15秒内完全灭活,Omicron变异株在40%EA作用下15秒内完全灭活(如图2A和补充表S3所示)。因此,Alpha、Beta、Delta和Omicron变异株对乙醇的抗性略高于武汉株系。然而,在人体皮肤表面进行的离体评价显示,所有病毒均在暴露于35%EA中15秒后实现完全灭活(对数减少值>4;如图2B和补充表S4所示)。
讨论
2020年,有多项研究(6,7,15)报告了武汉株系的环境稳定性。此外,一些研究表明,Alpha和Beta变异株具有同等程度的环境稳定性(8,9)。然而,尚无研究直接比较其他高关注变异株与武汉株系,武汉株系与所有高关注变异株(包括Omicron和Delta 变异株)在环境稳定性方面的差异尚未可知。
本研究显示,在塑料和皮肤表面,Alpha、Beta、Delta和Omicron变异株的存活时间比武汉株系长两倍以上,且在皮肤表面的传染性持续超过16小时。这些高关注变异株的高环境稳定性可能会增加接触传播的风险,导致高关注变异株进一步扩散。此外,该分析还显示,Alpha和Beta变异株在存活时间方面无显著差异,环境稳定性相似,这一结果与之前的研究结果一致(8,9)。
随着全球感染人数的迅速增加,Omicron变异株成为目前人们主要关注的问题。Omicron变异株传播迅速,其潜在因素可能在于感染靶部位从下呼吸道转移至上呼吸道以及该变异株的中和抗体逃逸机制(1-5)。本研究表明,在诸多高关注变异株中,Omicron变异株的环境稳定性最高,这表明,这种高稳定性也可能是导致Omicron变异株取代Delta变异株并迅速传播的原因之一。
尽管Alpha、Beta、Delta和Omicron变异株在环境稳定性增加的情况下乙醇抗性也略微增加,但皮肤表面所有高关注变异株均可在暴露于35%EA中15秒后完全失活。因此,按照世界卫生组织的提议,强烈建议使用具有适当EA浓度的消毒剂(>52 w/w%或>60 v/v%)作为当前的感染控制(手部卫生)手段(16,17)。
本研究存在三个局限性。首先,现阶段尚不知晓Alpha、Beta、Delta和Omicron变异株环境稳定性较高的原因所在,使用重组病毒进行评价可能能够找出决定这一点的各项因素。其次,此次环境稳定性评价中获得的存活时间和半衰期可能受外部环境和含病毒体液组成变化的影响。本研究为准确分析各高关注变异株之间的稳定性差异,采用了超速离心法纯化靶病毒,并以PBS作为溶剂。第三,现阶段尚不明确表面残留病毒量与传播风险之间的关系。因此,将本研究中的存活时间值理解为一项参考值可能更为合理。
综上所述,本研究阐明了各高关注变异株的环境稳定性,为感染控制提供了重要参考信息。此外,结合遗传分析,这些研究结果将有助于阐明高关注变异株的传播机制。
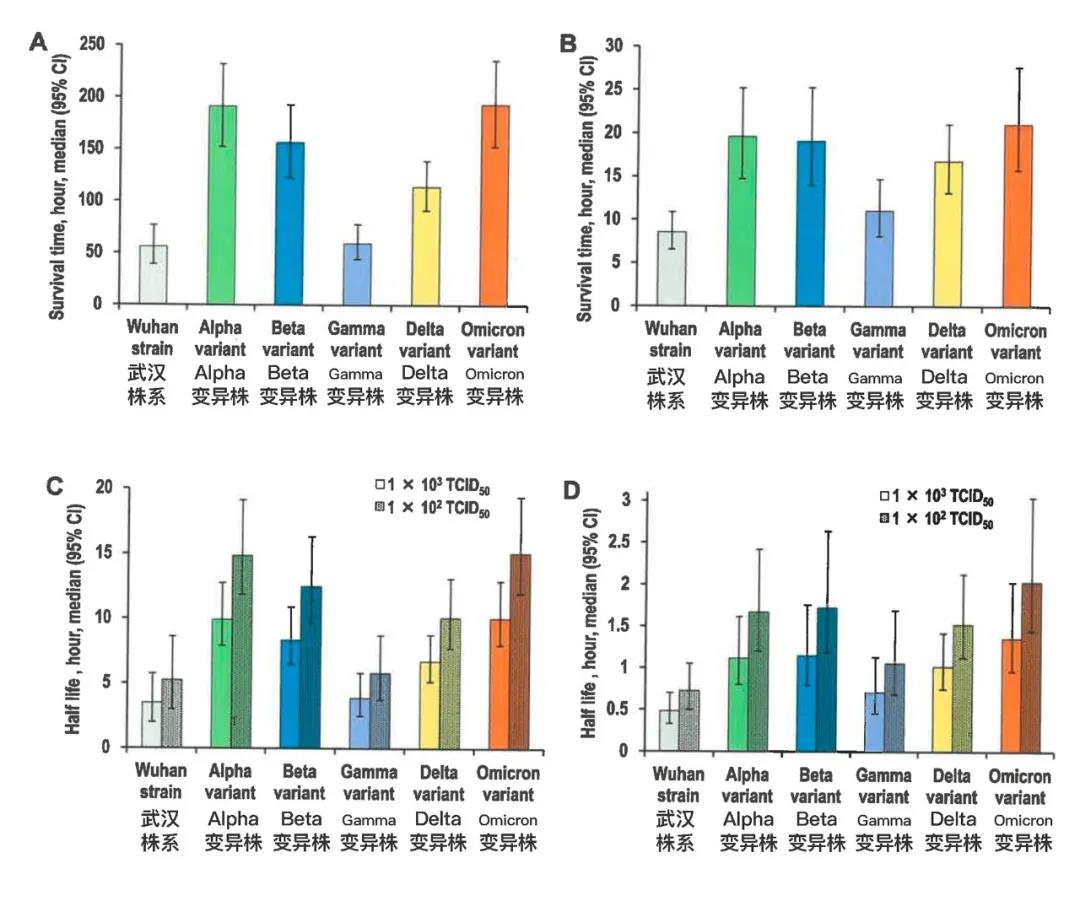
图1病毒在塑料和皮肤表面的存活时间和半衰期(A、C)
各种病毒在塑料表面的存活时间(A)和半衰期(C)(B、D)各种病毒在人体皮肤表面的存活时间(B)和半衰期(D)存活时间指表面无法检测出病毒的时间。图中所有半衰期均指皮肤表面残留1×102或1×103TCID50(半数组织培养感染剂量)病毒时的半衰期。数据以中位数±95%置信区间表示。
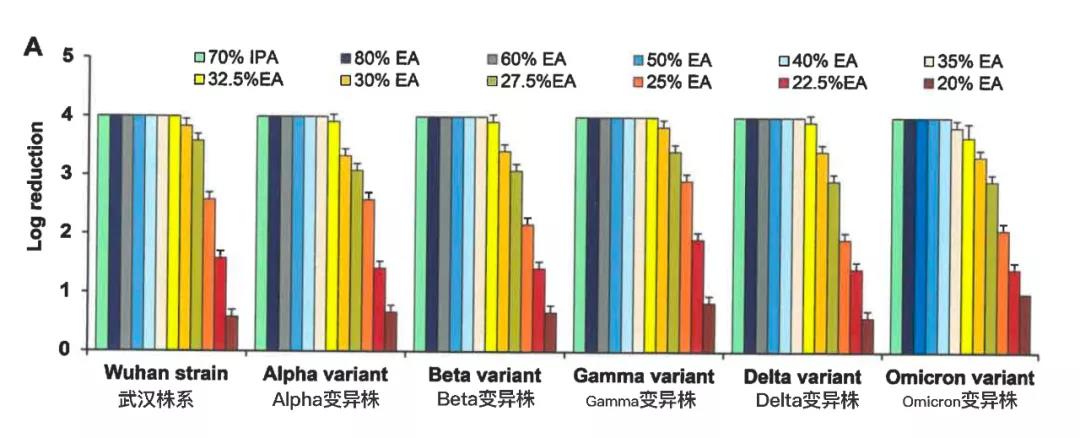
图2.消毒效果评价研究进行了体外评价(A)和离体评价(B),并根据每次醇基消毒剂暴露后的残留病毒滴度计算对数减少值(见补充表S3和S4)。结果以平均值±标准误表示。EA,乙醇;IPA,异丙醇。
参考文献
1.Tracking SARS-CoV-2 variants: World Health Organization; 2021 [Available from: ht1ps://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.
2.SARS-CoV-2 B. 1.1.529 (Omicron) Variant – United States, December 1 -8, 2021. MMWR Morbidity and mortality weekly report. 2021;70(50):1731-4.
3.National Center for I, Respiratory Diseases DoVD. Science Brief: Omicron (B. 1.1.529) Variant. CDC COVID-19 Science Briefs. Atlanta (GA): Centers for Disease Control and Prevention (US)
Unless a copyright is indicated, information on CDC’s sites, blogs, and applications is in the public domain and may be copied and distributed without permission.; 2020.
4.Enhancing readiness for Omicron (B. 1.1.529): Technical brief and priority actions for Member States. World Health Organization: World Health Organization; 2021 [Available from: https://www.who.int/docs/default-source/coronaviruse/2021-12-23-global-technical-brief-and-priority-action-on-omicron.pdf?sfvrsn==d0e9fb6c_8.
5.He X, Hong W, Pan X, Lu G, Wei X. SARS-CoV-2 Omicron variant: Characteristics and prevention. MedComm. 2021;2(4):838-45.
6.Hirose R, Ikegaya H, Naito Y, Watanabe N, Yoshida T, Bandou R, et al. Survival of SARS-CoV-2 and influenza virus on the human skin: Importance of hand hygiene in COVID-19. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2020.
7.van Doremalen N, Bushmaker T, Morris DH, Holbrook MG, Gamble A, Williamson BN, et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 2020;382(16): 1564-7.
8.Pottage T, Garratt I, Onianwa O, Spencer A, Paton S, Verlander NQ, et al. A comparison of persistence of SARS-CoV-2 variants on stainless steel. The Journal of hospital infection. 2021;114:163-6.
9.Meister TL, Fortmann J, Todt D, Heinen N, Ludwig A, Briiggemann Y, et al. Comparable Environmental Stability and Disinfection Profiles of the Currently Circulating SARS-CoV-2 Variants of Concern B.l.1.7 and B. 1.351. The Journal of infectious diseases. 2021;224(3):420-4.
10.Matsuyama S, Nao N, Shirato K, Kawase M, Saito S, Takayama I, et al. Enhanced isolation of SARS-CoV-2 by TMPRSS2-expressing cells. Proceedings of the National Academy of Sciences of the United States of America. 2020;117(13):7001-3.
11.Matsuyama S, Nagata N, Shirato K, Kawase M, Takeda M, Taguchi F. Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. Journal of virology. 2010;84(24): 12658-64.
12.Hirose R, Itoh Y, Ikegaya H, Miyazaki H, Watanabe N, Yoshida T, et al. Evaluation of the Residual Disinfection Effects of Commonly Used Skin Disinfectants against Viruses: An Innovative Contact Transmission Control Method. Environmental Science & Technology. 2021;55(23):16044-55.
13.Barcena M, Oostergetel GT, Bartelink W, Faas FG, Verkleij A, Rottier PJ, et al. Cryo-electron tomography of mouse hepatitis virus: Insights into the structure of the coronavirion. Proceedings of the National Academy of Sciences of the United States of America.2009;106(2):582-7.
14.Hirose R, Bandou R, Ikegaya H, Watanabe N, Yoshida T, Daidoji T, et al. Disinfectant effectiveness against SARS-CoV-2 and influenza viruses present on human skin: model-based evaluation. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2021.
15.Chin AWH, Chu JTS, Perera MRA, Hui KPY, Yen HL, Chan MCW, et al. Stability of SARS-CoV-2 in different environmental conditions. The Lancet Microbe. 2020;l(l):el0.
16.Golin AP, Choi D, Ghahary A. Hand sanitizers: A review of ingredients, mechanisms of action, modes of delivery, and efficacy against coronaviruses. American journal of infection control. 2020;48(9): 1062-7.
17.Infection prevention and control during health care when novel coronavirus (nCoV) infection is suspected. World Health Organization.: World Health Organization; 2020
[Available from:https://www.who.int/publications/i/item/10665-331495.